«Non bisognerebbe immaginare che nella natura della materia vi sia qualcosa che effettivamente ruoti.»
Max Born
La giornata di ieri comincia così: di primo mattino, due giovani studenti (chissà se pure loro sono disperati quanto me?!) si ritrovano a discutere di raggi x, coseni di angoli e altra robetta strana che mi fa subito subito sbarrare gli occhi, drizzare i capelli e abbassare il volume della musica (eh già, cosa mai sarei io senza le mie amatissime cuffiette?). Non mi ci vuole molto a capire che si tratta di due fisici, anche perché qualche secondo dopo se ne escono con un “L’abbiamo fatto pure ad astronomia”.
Astronomia. Una delle più grandi passioni di mio cugino – anche lui fisico. Mi scappa un sorrisetto ripensando al giorno in cui, tornata finalmente a mensa dopo mille peripezie che non vi sto a raccontare, sono capitata con 3 FISICI al tavolo (della serie: manco quando si mangia si può stare a non pensare a cose assurde!). Tra l’altro discutevano di Dirac e, sul momento, mi sono persino chiesta se anche loro frequentassero il corso di laurea in Chimica. Non mi sembrava di averli mai visti prima, però. Effettivamente, scopro che sono “miei acerrimi nemici” non appena dalle loro bocche esce la parola “Ottica”.
Scuoto la testa. Loro “acerrimi nemici”? E pensare che noi chimici dovremmo, per certi versi, starli persino a ringraziare (lo ammetto, mi è ancora tremendamente difficile accettare il fatto che la Fisica possa vivere senza la Chimica [se escludiamo magari ambiti come Elettrochimica e Fisica Atomica], ma che il viceversa non sia vero)! D’altronde… il concetto di ibridazione degli orbitali non esiste forse grazie a loro? Se è da queste “misteriosissime” entità, ovvero quelle zone in cui “risulta massima la probabilità di trovare un elettrone” – e che noi, appunto, ci accingiamo a chiamare orbitali – e da questo “magico artifizio” – alias ibridazione – che noi possiamo spiegarci i legami chimici, l’eventuale formazione di composti e, dunque, la stessa chimica come la conosciamo oggi, chi dovremmo ringraziare se non i cari (io, ve lo dico, all’università li ho maledetti a più riprese, ma… ma facciamo finta di niente per amor della scrittura!!!) Bohr, De Broglie, Planck, Shröedinger, Heinsenberg, Pauli, Hund, Born, Bloch & Purcell, il già citato Dirac e mille altri mostri (passatemi il termine, perché per me un qualcosa di inumano ce l’avevano!)? Per non parlare della duplice natura degli elettroni!
Che poi, a proposito di elettroni… ma quanto era bello starsi a scrivere le varie configurazioni elettroniche degli elementi (alias: come sono disposti gli elettroni in un atomo e, quindi, nei suoi vari orbitali?) disegnando fior fior di caselline che al liceo mi divertivo pure a colorare con i pastelli (d’altronde, dovevo pur distinguere gli orbitali s dagli orbitali p, come i vari livelli energetici di ciascun atomo, no?) per poi paragonare quella scaletta a un’impervia salita che dagli elettroni più interni (anche detti elettroni di core) portava a quelli più esterni (i cosiddetti elettroni di valenza – alias: i diretti responsabili dei legami chimici)? Una sorta di scaletta alla Starway To Heaven, benché molto più rozza e, ve lo concedo, molto meno affascinante. Però a ben pensarci, agli elettroni solitamente piace stare nel largo, e noi non siamo poi troppo diversi da loro. E tutte quelle caselline intrise di elettroni formato freccia, rigorosamente con spin antiparallelo ↑↓ (in modo estremamente rozzo e semplicistico – e senza quindi dare retta alle parole di Max Born! – possiamo dire che l’elettrone sia in grado ruotare in senso orario o antiorario e che questo misterioso spin si può di fatto considerare una “proprietà” dello stesso elettrone – tra l’altro indicante questa rotazione) e NON più di due per casella (sennò il buon vecchio Pauli si rivolta nella tomba!) era piuttosto curioso da vedere, soprattutto per noi neofiti.
Supponiamo infatti di avere tre caselline quadrate (dove ognuna di queste rappresenta uno specifico orbitale [lasciate perdere di che tipo!] di un altrettanto specifico atomo) disposte in fila. Se, per esempio, 3 elettroni (che rappresentiamo con delle freccine) dovessero decidere come disporsi all’interno di questi 3 orbitali, in che modo potrebbero farlo? In prima battuta potremmo pensare, sempre applicando il cosiddetto Principio di Esclusione di Pauli, che possano sistemarsi in base a una configurazione di questo tipo:
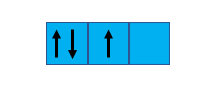
In realtà, questa configurazione non è quella corretta. Certo, se conoscessimo soltanto la regoletta di Pauli potremmo certamente dire che sì, i nostri cari elettroni si siano aggiustati nella maniera più efficiente possibile: d’altra parte, ve ne sono al massimo due per ciascun orbitale, rigorosamente con le frecce rivolte in senso opposto (ossia con spin antiparallelo ↑↓). La regoletta di Pauli è quindi rispettata.
Cosa c’è che non va? Abbiamo detto prima che agli elettroni “piace stare nel largo”, e di fatto questo tipo di configurazione non ottimizza questa loro, egoistica voglia di starsene per i fatti propri! Ci viene dunque in aiuto l’illustre Hund, che tramite il cosiddetto Principio della Massima Molteplicità ci dimostra che… che (come già anticipato) pure noi esseri umani non siamo poi tanto diversi dagli elettroni! Senza nemmeno saperlo, applichiamo infatti molto spesso questo Principio appena citato (lo espliciteremo a breve!).
Pensate a tutte le volte che ci è capitato di prendere il pullman (o magari il treno). D’istinto (e forse per l’intrinseca “repulsione” che ci coglie al pensiero di dover condividere il proprio posto con un estraneo e, ciò nondimeno, per quella voglia primigenia di rivendicare spazi che, comunque sia, restano “nostri” giusto il tempo di qualche ora), non ci affrettiamo forse ad appropriarci di quella postazione composta da due comodi sedili (della serie: orbitale vacante, sei mio!!!) che nessun altro ha “pensato” di occupare prima di noi? Certo, quando poi il numero di posti disponibili diminuisce drasticamente, ovviamente ci si ritrova a chiedere permesso alla persona di turno per poterglisi sedere accanto. Ed ecco che l’ultimo posto poco prima disponibile è stato occupato. Volendo continuare a pensare a questi due sedili come a un unico orbitale, possiamo quindi dire che tale orbitale, che prima era semivacante (semivuoto), adesso non lo è più. Abbiamo un orbitale pieno. Quale sarà la probabilità che i due passeggeri si scornino tra di loro? Nei casi più fortunati sarà prossima allo zero ma, in linea generale, non ci è dato di saperlo (e qua potremmo persino evocare, sempre storpiando un qualche cosa, il caro vecchio Heisenberg: conosciamo sì la nostra esatta posizione, ma non conosciamo certamente la natura di chi ci è capitato accanto!).
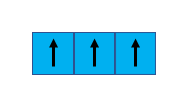
Per gli elettroni, invece, un qualche cosa si sa. In base alla regola di Hund, queste particelle – a cui convenzionalmente è stata assegnata carica negativa – tendono a occupare il massimo numero di orbitali vuoti disponibili (Principio della Massima Molteplicità). Ergo, i 3 elettroni chiamati in causa precedentemente si disporranno nel seguente modo:
Ve ne sarà dunque uno per ciascuna casella (abbiamo quindi 3 orbitali semivacanti), convenzionalmente con spin parallelo (↑). Il motivo di questa disposizione risiede nella minimizzazione della repulsione tra queste particelle. Dato che, in base alla Fisica “elementare” (elementare di nome ma non di fatto, sigh!), cariche di segno uguale si respingono, l’interazione di tipo repulsivo tra le stesse risulterebbe nettamente maggiore se gli stessi elettroni popolassero il medesimo orbitale. Della serie: se esiste un posticino vuoto, perché non occuparlo?
In laboratorio, invece… più che stare nel largo siamo tutti compatti, uniti all’inverosimile! Se è ormai assodato che un certo numero di elettroni orbiti attorno al nucleo di un determinato atomo, noi studenti – perennemente insicuri – non manchiamo mai di girare in tondo, in lungo e in largo per tutto il laboratorio, ora guardando l’opera di uno studente, ora guardando quella di un altro. Emulazione, curiosità, la segreta speranza che “un lampo di genio” ti regali la tanto bramata consapevolezza che il tutto stia procedendo secondo i piani. Tranne quando alla docente sale la brillante ideuzza di modificare in corso d’opera la ricetta dell’esperienza, impedendo allo studente di seguirla in maniera pedissequa. Causando, tra l’altro, delle mancate precipitazioni di composto che alla fin fine, nei casi peggiori, non si riescono nemmeno a risolvere del tutto! State attenti, quindi. Perché gli strambi (e improvvisi!) artifizi di un professore possono esservi, alcune volte, davvero fatali. Cosicché, da una resa del “prodotto 2” del 33% (anzi, pensavo peggio!) potreste ritrovarvi con non si sa cosa. Devo ammettere, però, che questa volta mi sono troppo divertita (mi sono sentita molto più competente e ho fatto anche più operazioni rispetto alla volta scorsa), perciò non posso che augurarmi la stessa cosa per le prossime esperienze!
Unico inconveniente? La piridina. E cosa caspita è? – vi starete chiedendo. Non è nient’altro che un composto aromatico (un’ammina ciclica, per essere precisi) dall’odore… Insomma, ce l’avete presente il mercato del pesce? Ecco, più o meno siamo lì. E se a un certo punto il laboratorio viene infestato da quella fragranza così meravigliosa (e menomale che abbiamo lavorato sotto cappa!), bisogna affrettarsi a chiudere baracca e burattini per tornare a respirare aria pulita.
Ergo… state ben attenti pure a lei!

Non ricordo più quale fisico ha detto che “la Chimica è la parte disordinata della Fisica”.
Per darne una riprova: vedere “aufbau” citato tra i nomi di fisici… “aufbau” in tedesco significa “costruzione interna”, non è un nome di persona! 😄
Sarò pure una “linguista”, ma il tedesco non lo conosco proprio, a parte un paio di parole… Perlomeno sono stata coerente nel mostrare la mia ignoranza in materia!
Però, a mia “discolpa” posso dire che su tutti i libri pongono ‘sto benedetto “Principio (o Regola) di Aufbau” con la lettera maiuscola (alla stregua di quello di Pauli/Heisenberg…), forse perché in tedesco, ora che ci penso, anche i nomi comuni vengono scritti in maiuscolo, oltre al fatto di avvalersi, se non erro, delle declinazioni come nella lingua latina… (sono ignorante, sì, ma un qualcosa mi aveva detto un mio caro amico, che ha studiato questa lingua all’università)!
E quindi niente, convinta che rientrasse anche “lui” tra i fisici del tempo, ma a questo punto lo tolgo dal post (adesso mi spiego perché su internet non ero riuscita a trovare nessuna foto su “un lui” che, a tutti gli effetti, era semplicemente inesistente!)…
Se trovi una foto di Konrad Aufbau da qualche parte, però, ti prego di mostrarmela! 😄
Konrad? 😅
Beh, forse potevi arrivare al fatto che non fosse un nome di persona se pensavi alla scuola del bauhaus, ovvero “costruzione della casa”.
Però in effetti “hund” in tedesco vuol dire “cane”.
Comunque dei fisici da te citati, non ho mai sentito nominare Bloch e Purcell.
Che io (ovviamente) non conosco, ma vabbè…
Però non ho capito… ma perché “Konrad”? “Konrad, chi era costui?” tanto per “riscomodare” e semicitare Manzoni…
Comunque, riguardo a Bloch e Purcell, sono stati due NMRisti che hanno vinto il Premio Nobel per aver scoperto la teoria che si basa sulla risonanza magnetica nucleare del protone… Ci sono stati citati insieme ad altri fisici al corso di Organica III…
Ah ok. Magari sono stati citati al corso di Risonanze Magnetiche al 4° anno, o forse no, non me li ricordo proprio.
Konrad era per tirar fuori un possibile nome tedesco da associare ad Aufbau… era solo una battuta… 😄
E negli anni ’80 c’era anche un gruppo rock inglese che si chiamava Bauhaus, che prendeva il nome proprio da quella scuola tedesca…
Ah ecco, allora un angolino del mio cervello aveva immaginato bene… Mi hai talmente abituata a prenderti sul serio, che poi finisce che manco lo capisco se/quando fai battute!
Eh, pensa ai miei studenti, ché manco loro se lo aspettano…
O quando a lezione cito i supereroi, come quando abbiamo visto i materiali di cui è fatto il costume di Batman…