Volevo raccontare la storia di un atomo di carbonio… Il nostro personaggio giace dunque da centinaia di migliaia di anni, legato a tre atomi di ossigeno e uno di calcio, sotto forma di roccia calcarea: ha già una lunghissima storia alle spalle, ma la ignoreremo… Nell’anno 1840, un colpo di piccone lo staccò e gli diede l’avvio verso il forno alla calce, precipitandolo nel mondo delle cose che mutano.
Venne arrostito affinché si separasse dal calcio…; lui, tuttora fermamente abbarbicato a due dei tre suo compagni ossigeni di prima, uscì per il camino e prese la via dell’aria. La sua storia, da immobile, si fece tumultuosa…
Primo Levi
Introduzione
È davvero incredibile che da un solo atomo degli attuali 118 presenti nella Tavola Periodica degli elementi, dipenda tutta la nostra vita. Ebbene sì, stiamo parlando dell’atomo di carbonio. È ormai assodato che la nostra intera esistenza dipenda soltanto da lui e, in buona sostanza, dai suoi stretti e fidati “collaboratori”. I suoi partner ideali quali lo zolfo (S), l’azoto (N), l’ossigeno (O), gli alogeni (-X) ed in primis l’idrogeno (H), l’elemento della Tavola Periodica con il quale il carbonio ha un rapporto davvero speciale.
Il meraviglioso frammento riportato nell’introduzione, concernente la tumultuosa esistenza di questo misterioso elemento chimico denominato carbonio, appartiene alla grandiosa opera letteraria del chimico e scrittore Primo Levi, dal titolo “Il Sistema Periodico”. Ma non solo. Questo suddetto racconto, di cui ho riportato solamente le primissime righe, è di fatto l’introduzione che gli autori del mio “Eserciziario di Chimica Organica” hanno scelto per introdurre una materia affascinante (quanto terribile!) ma dai risvolti davvero complessi, nonché dai “mille volti” – alcuni di questi particolarmente spiacevoli – e dalle mille sfaccettature attraverso le quali la stessa si presenta agli occhi di “quei (s)fortunati studenti” che si apprestano a scoprirne i principi.
Insomma, questa vastissima disciplina può riservare delle grandi e sconvolgenti sorprese, nonché delle difficoltà a prima vista insormontabili, ma spero che con questo mini “libercolo” interattivo diviso in sezioni, il tutto vi (emh… mi) apparirà molto più semplice (o almeno è quello che mi auguro) di quanto non sia in realtà. Il che sarà davvero una fortuna… O una sfortuna? Come al solito, il silenzioso o rumoroso giudizio spetterà a voi lettori (sempre che abbiate avuto il coraggio di aprire questo post)! Ovviamente, se riscontrate degli errori/imprecisioni, come disse una volta il mio vecchio professore di CF1, “tirate fuori la lingua dalla chiostra dei denti!”
Prima di fiondarci in questa sorta di viaggio all’interno dell’infinitamente piccolo o grande che sia, viene però da chiedersi: per quale motivo dovrei scrivere una serie di post del genere? Allora, innanzitutto, perché è da moltissimo tempo che non parlo di Chimica su questo blog – se non per “lamentarmi” delle difficoltà che di volta in volta si presentano sul mio cammino! -. In secondo luogo, mi appresto a pubblicare questa serie di post (anche se il suddetto lo avevo già bello che pronto da mesi) a seguito del terzo tentativo fallito nel superare l’esame di questa disciplina (ebbene sì, a quanto pare sono più dura del marmo di Carrara, avendo battuto il record di Analisi II… !) in modo da motivarmi ancora di più nell’aprire il libro per l’ennesima volta e trovare “il coraggio” di svolgere gli astrusi esercizi dei vecchi compiti (e rompere gentilmente le scatole alla professoressa a seguito del miei probabili fallimenti nella risoluzione, dato che non dispongo nemmeno delle soluzioni! 🙄 ), sperando che arrivi la volta buona.
In ultimo, ma non per questo meno importante, dovete sapere che la colpa di tutto questo “marasma” cui assisterete (ripeto, non vi mostrerò nel dettaglio le terribili prodezze di cui è dotata ogni singola classe di composti!) non è stata mia, bensì dei geniali autori dell’eserciziario di Chimica Organica menzionato all’inizio. Ogni singolo capitolo del testo è infatti corredato da alcune citazioni letterarie & CO., in qualche modo collegabili con i concetti scientifici trattati dagli stessi capitoletti.
Non appena avevo cominciato a sfogliare l’opera, in effetti, ho pensato nell’immediato che la stessa fosse stata concepita apposta per me. In fondo, a pensarci bene, tutte le strade (mi) portano alla scrittura e, questa volta, la stessa ci condurrà attraverso un multiverso di molecole con le quali abbiamo a che fare più o meno tutti i giorni, molto spesso senza nemmeno saperlo.
1 a) Prima (spinosa) questione: Come si può rappresentare una molecola?
Una risposta è il tratto di strada che ti sei lasciato alle spalle. Solo una domanda può puntare oltre.
J. Gaarder, C’è nessuno?
Per comprendere appieno questa citazione letteraria tratta dal romanzo di Gaarder, ho dovuto ricercarne la trama su internet. Il protagonista del libro è Joackin, un bambino che instaura un’amicizia con uno strano ragazzino appeso ad un albero a testa in giù. In realtà, quel ragazzino è un alieno di nome Mika, simile agli essere umani. Questo saggio filosofico si propone, in buona sostanza, di stimolare la fantasia dei lettori invitandoli a porsi delle domande, anche se decisamente strane. Ecco, adesso noi potremmo assimilare tali stranezze alle molecole, delle “misteriose” entità fisiche che non conosciamo davvero (se non attraverso uno studio approfondito di queste), né tanto meno possiamo vedere macroscopicamente.
In compenso, sappiamo che queste esistono e che si nascondono ovunque: nel cibo che mangiamo, nei vestiti che indossiamo… Noi stessi “siamo” la chimica. Non esiste oggetto, naturale o artificiale che sia, che non sia composto da elementi chimici. Ma nel qual caso si voglia studiare quell’oggetto a livello microscopico, (e dunque analizzarne la struttura molecolare) come possiamo fare? Da un punto di vista filosofico, trasposto nel caso scientifico, intuitivamente dedurremo che è necessario “guardare oltre” la semplice formula chimica che rappresenta e descrive un dato composto chimico, al fine di poterne davvero comprendere le proprietà.
Al fine di ovviare ad eccessive difficoltà, sono state perciò sviluppate delle “illustrazioni” che ci permettano di visualizzare “concretamente” queste strane – quanto comuni – entità. In effetti, scrivere solamente H2O non ci regala molte informazioni in merito alla struttura dell’acqua e in linea generale dei composti presi in esame. Parafrasando Gardeer, bisogna dunque puntare oltre. Come? Innanzitutto, dovete sapere che la Chimica Organica si avvale di un giochino compiuto da particelle piccolissime aventi carica negativa: gli elettroni (esatto, “è tutta colpa loro”)!
In particolar modo, tutti gli elementi possiedono un determinato numero di elettroni che orbitano intorno al nucleo dell’atomo. Ma solamente gli elettroni definiti esterni (ciò quelli più lontani dal nucleo) ne determinano la reattività (o l’inerzia, nel caso dei gas nobili), in quanto maggiormente liberi di muoversi. Punto secondo: voi saprete certamente che vari elementi possono combinarsi tra di loro per formare una molecola/composto, instaurando perciò dei legami chimici. Nel caso dell’acqua, idrogeno e ossigeno si combinano al fine di crearla.
Ma nel caso nel carbonio? Esiste una “massima fondamentale”: nella chimica ordinaria, il carbonio può formare al più quattro legami. Il carbonio possiede perciò quattro elettroni esterni (o di valenza) con i quali poter formare una miriade di composti con altri elementi, tutti differenti tra loro per proprietà chimiche e reattività. No, per quanto il carbonio sia in grado di formare legami forti – nonché stabili – con se stesso (a differenza del silicio, per esempio) “egli” non può farcela da solo.
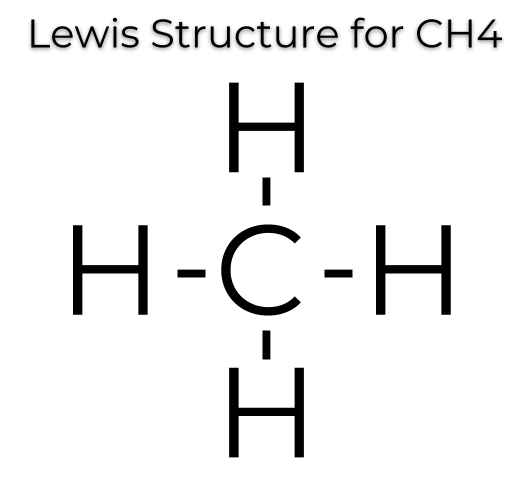
Proprio come qualunque essere umano, ha bisogno di “instaurare dei rapporti interpersonali” – nel suo caso sarebbe giusto dire “interatomici!” – con altri atomi, anche molto diversi da lui. Il suo più fido amico resta comunque l’atomo di idrogeno (H), che possiede un solo elettrone esterno. Perché proprio lui, viene da chiedersi? Chissà, magari perché questo risulta essere l’elemento chimico più abbondante presente nel nostro universo, oltre al fatto che “egli” stesso non “pretende troppo dalla vita”: per mantenersi stabile, gli basta possedere due elettroni nel suo guscio esterno, al fine di raggiungere la stessa condizione di stabilità del “compagno” che lo segue nella Tavola Periodica, il gas nobile elio (He). Il composto organico più semplice che si conosca è il metano, di formula CH4. Il carbonio condivide i suoi 4 elettroni esterni con l’idrogeno, che come detto poc’anzi ne possiede uno solo.
La formula illustrata qui sopra viene chiamata formula di struttura o di Lewis (dal nome del chimico che l’ha proposta), e serve per riuscire a visualizzare con maggior chiarezza la disposizione dei legami chimici degli atomi all’interno del composto (evidenziando anche il comportamento degli elettroni), in questo caso un semplice idrocarburo. Ad ogni modo, il disegnino di sopra non è l’unica rappresentazione possibile. Quando abbiamo a che fare con molecole molto grandi composte da molti atomi, può essere utile proporre dei modelli diversi ma comunque efficaci per disegnarne in modo più veloce la struttura.
Ed è proprio in questo momento che entra in gioco la seconda citazione.
1 b) Seconda (spinosa) questione: strutture condensate
Confondere un modello con la realtà è come andare al ristorante e mangiare il menu.
A. Bloch
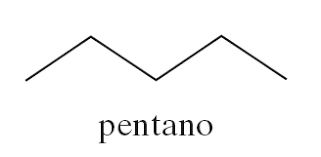
Come suggerisce il termine “condensate” del titolo a questo paragrafo, in alcune rappresentazioni si omette un qualcosa che c’è, ma che non è fondamentale evidenziare. Per esempio, il legame carbonio idrogeno potrebbe essere rappresentato in due modi: C – H oppure CH. I due elementi sono comunque legati tra di loro, ma nella seconda formula il trattino che designa il legame viene omesso. Esiste poi un’altra rappresentazione che viene denominata come “struttura segmentata”.
In tal caso, le molecole vengono rappresentate attraverso dei segmenti in cui ad ogni estremità degli stessi corrisponde un atomo di carbonio. Anche in questa rappresentazione vengono omessi gli atomi di idrogeno. Ma la “regola di base” è sempre la stessa: il carbonio forma sempre e soltanto 4 legami. Queste rappresentazioni “a zig-zag” sono sicuramente meno intuitive delle precedenti, pur essendo molto più comode qualora si trattino molecole complesse a lunga catena. A ogni modo, i gruppi funzionali delle stesse (di cui si chiarirà il significato nei prossimi post) vengono sempre esplicitati. La molecola qui sotto si chiama pentano e il prefisso greco -penta indica il fatto che questa abbia cinque atomi di carbonio.
Ma che cosa c’entra la citazione introduttiva a questo paragrafo con le rappresentazioni delle molecole di cui abbiamo discusso?
In realtà, il discorso sarebbe di una portata davvero molto ampia, ma cercherò di essere breve. Nelle scienze in generale, si è soliti costruire dei modelli approssimativi che non rappresentano a tutti gli effetti la realtà che ci circonda, pur descrivendola in un modo abbastanza preciso. I modelli si propongono, dunque, di spiegarci più semplicemente una realtà dai risvolti complessi ma che poi troveranno effettivo riscontro – o smentita – attraverso molteplici esperimenti.
Se pensiamo agli innumerevoli modelli che si sono adottati al fine di descrivere la struttura dell’atomo, per esempio, ci si accorge nell’immediato dell’effettiva progressione attraverso la quale si è infine giunti al modello atomico attuale (e qua bisognerebbe chiamare in causa la Chimica-Fisica per spiegarlo in modo specifico…), a seguito di molteplici errori che però hanno permesso agli scienziati di comprendere nel profondo la struttura dell’atomo.
In questo caso, però, ci si deve ben guardare dal propugnare certezza assoluta! Il modello atomico di Heisenberg è quello che effettivamente descrive al meglio la realtà in cui viviamo, però potrebbe non rappresentarla del tutto! Magari, un bel giorno, uno scienziato dall’ammirevole fantasia potrebbe – basandosi su presupposti già universalmente accettati – anche proporne un altro, benché sia davvero difficile che ciò accada.
Rimanendo nel campo della Chimica Organica, comunque, ci sarà un’altra (spinosa) questione inerente le molecole – definita risonanza – che però analizzeremo più avanti. Anche in questo caso, l’espediente di cui ci serviremo ci sarà molto utile per descrivere al meglio una proprietà molecolare dalla quale discendono, “a cascata”, tutte le altre. Il tizio citato nell’introduzione, A. Bloch, è uno scrittore statunitense, ben noto per aver redatto dei libri che hanno come protagonista la “Legge di Murphy”:
|
«Se qualcosa può andar male, lo farà.» |
Quante volte siamo stati testimoni di questa frase? Beh, personalmente parlando, fin troppe volte!
3 a) Terza (spinosa) questione: rappresentazioni prospettiche
È solo una questione di prospettiva: in qualsiasi punto del cielo si trovi la luna e in qualsiasi parte del mondo tu sia, se alzi la mano e chiudi un occhio, non è mai più grande del tuo pollice.
Dal film Dear John, di Lasse Hallström
A me questa citazione non piace molto, per cui ve ne propongo un’altra dal film “L’attimo fuggente”:
Sono salito sulla cattedra per ricordare a me stesso che dobbiamo sempre guardare le cose da angolazioni diverse. E il mondo appare diverso, da quassù. Non vi ho convinti? Venite a vedere voi stessi. Coraggio! È proprio quando credete di sapere qualcosa che dovete guardarla da un’altra prospettiva.
“John Keating”
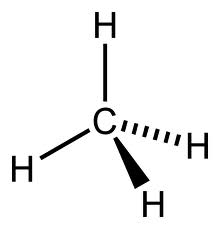
Le molecole non sono realmente piatte come sono state finora rappresentate, in modo bidimensionale. Queste hanno, infatti, una “consistenza ben definita”, essendo tridimensionali. Al fine di evidenziare tale caratteristica, alcuni legami di una molecola non vengono rappresentati tramite la semplice lineetta – . Riprendendo il metano CH4:
Due atomi di idrogeno vengono rappresentati dalla semplice linea, ma gli altri due godono di una prospettiva diversa. Quello con il cuneo pieno sta infatti ad indicare che il legame punta verso l’osservatore, mentre l’altro con il cuneo tratteggiato simboleggia il fatto che si trovi lontano dall’osservatore. Esisterebbero altri due modi di guardare una molecola ma, non essendo molto utilizzati, non li apporrò in questo post. Dalla struttura sovrastante, comunque, è possibile dedurre che le molecole hanno una specifica forma, o meglio, una ben nota geometria molecolare. Nel nostro esempio, la geometria del metano è tetraedrica.
TO BE CONTINUED…
Io speravo che, una volta uscito da quell’aula, non avrei più sentito parlare di chimica organica almeno per 3 mesi, e invece…
A parte gli scherzi, interessante! Che bella questa cosa delle citazioni letterarie prima dei capitoli! Seguirò questi post così mi darò un’altra rinfrescata di qualche concetto prima di iniziare il corso di chimica all’università…
Ciao Rael!
Guarda, nessuno può capirti meglio di me: non avrei mai voluto pubblicare questa “serie” in piena estate ma, complice il mio fallimento all’ultimo tentativo di conquista di un voto decente all’esame di organica (la meta è ancora lontana, ho fatto soltanto otto punti!), complice il mio atteggiamento non proprio positivo nell’affrontare le cose mesi addietro, nonché lo scarso tempo durante i semestri – in cui ho preferito pubblicare post con argomenti più leggeri – alla fine è arrivata la volta di questa materia! Diciamo che il mio umile obiettivo sarebbe quello di non sconvolgere nessuno con l’infarinatura generale di questi argomenti, in primis me stessa! Insomma, dovrò cercare di essere il più leggera possibile nei prossimi post, ma tu puoi benissimo esonerarti da tutto questo “marasma”! 😛
Dal canto mio, ho preferito non “piangermi addosso” per una volta e reagire di conseguenza, ahahah!
Tu che mi racconti? Com’è andato l’esame orale?
Ps: Goditi appieno questa estate e non studiare troppo per i test, perché purtroppo sarà l’ultima estate in cui ti sentirai veramente libero (io, invece… dovrò tentare per la quarta volta questo esame il 13 luglio)!
Sono sicuro che riuscirai a passare organica, e spero che al solito mettere le cose per iscritto ti aiuti. Sicuramente lo farà!
Ah già! L’esame è andato benissimo grazie! Direi che meglio di così non poteva andare. L’ansia è effettivamente (quasi) scomparsa dopo che ho iniziato a parlare. Meno male! E poi, i prof sono stati buoni, per fortuna.
Mi godrò quest’estate allora. Ma sono decisamente impaziente di iniziare, e dare una ristudiata agli argomenti per preparasi è comunque cosa buona. Non ho neanche nessun test da fare per l’università, l’ho già fatto un mesetto fa!
Ah, dimenticavo il nickname! Tengo Rael come omaggio al miglior album della storia della musica (ovviamente), ma chiamami pure Francesco!!
Ti ringrazio molto per l’incoraggiamento, Francesco! 🙂
Spero di vincere questa ardua battaglia, prima o poi! In effetti, mettere il tutto per iscritto in un certo senso rende la cosa un po’ più “umana” e, per certi versi, meno spaventosa!
Complimenti per l’esito più che positivo del tuo esame, anche se devo dire che non nutrivo dubbi al riguardo!
Hai ragione, ripassare qualcosina per non perdere l’allenamento allo studio è una cosa molto buona; nel frattempo che ti godi la “torrida freschezza” dell’estate! Ti sento molto carico per la nuova avventura che ti aspetterà, questo è senz’altro lo spirito giusto!
Quanto al nickname, in effetti non potevi sceglierne uno migliore!
Occhio, che è l’elio l’elemento più piccolo della tavola periodica! L’idrogeno è quello col minor numero di protoni.
In effetti il modello a orbitali non è dovuto a Heisenberg, pur basandosi sul suo principio di indeterminazione, bensì a Schrodinger (e/o Dirac). Possiamo dire che è un lavoro di gruppo.
Aspettavo il tuo intervento! Cavolo, hai ragione, ti ringrazio per la correzione, ho sempre paura di scrivere qualche castroneria e aver un prof a distanza aiuta molto ad “affinarsi”! Andrò a modificare la parte incriminata! 😊
Quanto a Dirac… lo sto studiando in questi giorni e spero di dare CF2 a settembre. Certo che è proprio tosta!